[ad_1]
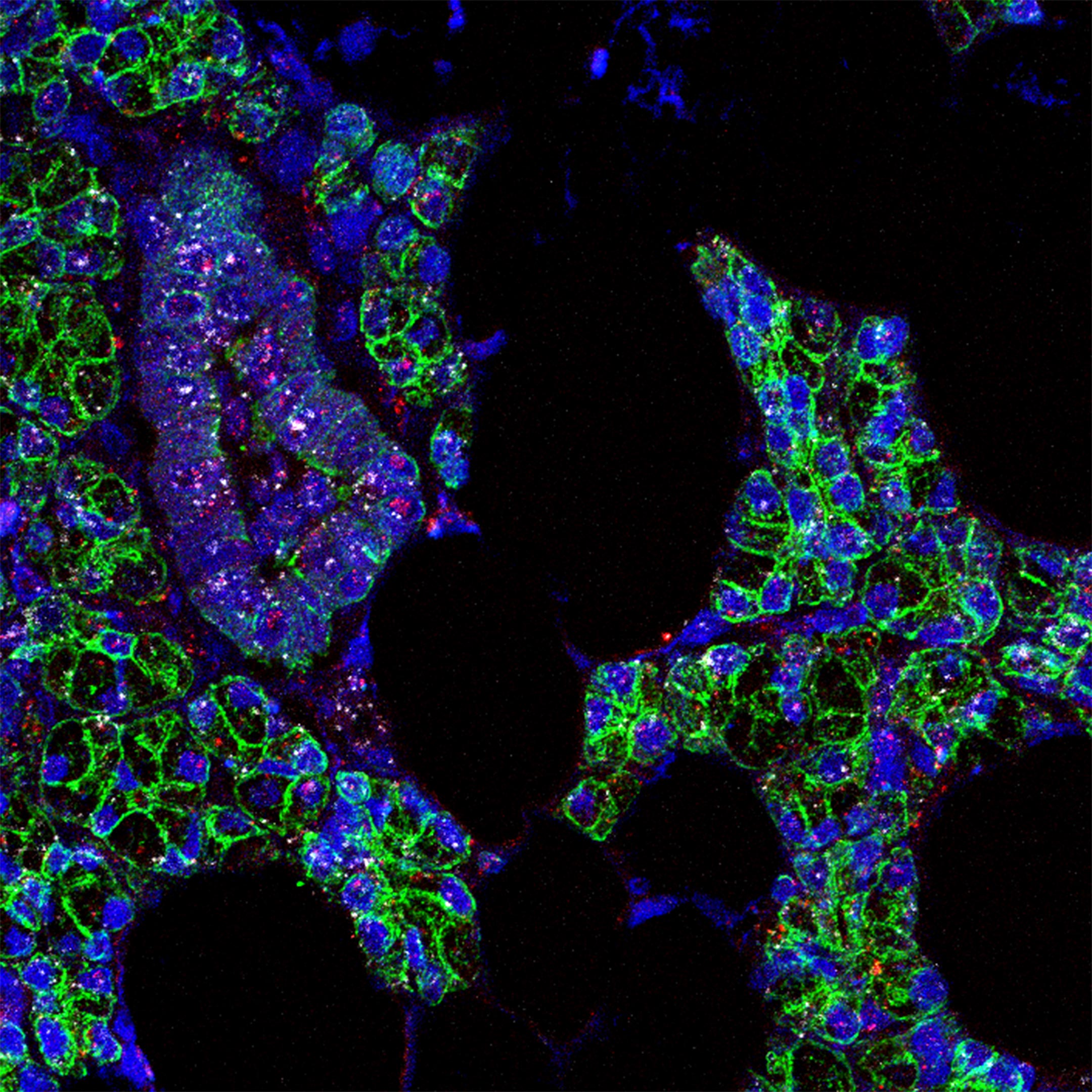
SARS-CoV-2 (pink) and ACE2 receptor (white) RNA was found in human salivary gland cells, which are boxed in green. Credit: Paola Perez, PhD, Warner Lab, NIDCR
NIH-funded findings indicate role of saliva in SARS-CoV-2 transmission.
An international team of scientists has found evidence that SARS-CoV-2, the virus that causes COVID-19[feminine, infecte les cellules de la bouche. Bien qu’il soit bien connu que les voies respiratoires supérieures et les poumons sont les principaux sites d’infection par le SRAS-CoV-2, il existe des indices selon lesquels le virus peut infecter les cellules d’autres parties du corps, telles que le système digestif, les vaisseaux sanguins, les reins nouvelle étude montre, la bouche.
Le potentiel du virus à infecter plusieurs zones du corps pourrait aider à expliquer les symptômes variés ressentis par les patients atteints de COVID-19, y compris des symptômes oraux tels que la perte de goût, la sécheresse de la bouche et les cloques. De plus, les résultats indiquent la possibilité que la bouche joue un rôle dans la transmission du SRAS-CoV-2 aux poumons ou au système digestif via la salive chargée de virus provenant de cellules orales infectées. Une meilleure compréhension de l’implication de la bouche pourrait éclairer les stratégies visant à réduire la transmission virale à l’intérieur et à l’extérieur du corps. L’équipe était dirigée par des chercheurs des National Institutes of Health et de l’Université de Caroline du Nord à Chapel Hill.
«En raison de la réponse pratique des NIH à la pandémie, les chercheurs de l’Institut national de recherche dentaire et craniofaciale ont pu rapidement pivoter et appliquer leur expertise en biologie buccale et en médecine pour répondre aux questions clés sur le COVID-19,» a déclaré la directrice du NIDCR, Rena D’Souza, DDS, MS, Ph.D. «La puissance de cette approche est illustrée par les efforts de cette équipe scientifique, qui a identifié un rôle probable pour la bouche dans l’infection et la transmission du SRAS-CoV-2, une découverte qui ajoute aux connaissances essentielles pour lutter contre cette maladie.
L’étude, publiée en ligne le 25 mars 2021 dans Médecine de la nature, était dirigée par Blake M. Warner, DDS, Ph.D., MPH, chercheur clinique adjoint et chef de l’unité des troubles salivaires du NIDCR, et Kevin M. Byrd, DDS, Ph.D., à l’époque professeur adjoint dans le Adams School of Dentistry de l’Université de Caroline du Nord à Chapel Hill. Byrd est maintenant un chercheur Anthony R. Volpe à l’American Dental Association Science and Research Institute. Ni Huang, Ph.D., du Wellcome Sanger Institute de Cambridge, Royaume-Uni, et Paola Perez, Ph.D., du NIDCR, étaient les co-premiers auteurs.
Les chercheurs savent déjà que la salive des personnes atteintes de COVID-19 peut contenir des niveaux élevés de SRAS-CoV-2, et des études suggèrent que les tests de salive sont presque aussi fiables que le prélèvement nasal profond pour diagnostiquer le COVID-19. Ce que les scientifiques ne savent pas tout à fait, cependant, c’est d’où vient le SRAS-CoV-2 dans la salive. Chez les personnes atteintes de COVID-19 qui présentent des symptômes respiratoires, le virus dans la salive provient peut-être en partie du drainage nasal ou des expectorations crachats des poumons. Mais selon Warner, cela n’explique peut-être pas comment le virus pénètre dans la salive des personnes dépourvues de ces symptômes respiratoires.
“Sur la base des données de nos laboratoires, nous soupçonnons qu’au moins une partie du virus dans la salive pourrait provenir de tissus infectés dans la bouche elle-même”, a déclaré Warner.
Pour explorer cette possibilité, les chercheurs ont étudié les tissus buccaux de personnes en bonne santé pour identifier les régions buccales sensibles à l’infection par le SRAS-CoV-2. Les cellules vulnérables contiennent ARN des instructions pour fabriquer des «protéines d’entrée» dont le virus a besoin pour pénétrer dans les cellules. L’ARN de deux protéines d’entrée clés – connues sous le nom de récepteur ACE2 et d’enzyme TMPRSS2 – a été trouvé dans certaines cellules des glandes salivaires et des tissus tapissant la cavité buccale. Dans une petite partie de la glande salivaire et des cellules gingivales (gomme), l’ARN pour ACE2 et TMPRSS2 a été exprimé dans les mêmes cellules. Cela indique une vulnérabilité accrue car on pense que le virus a besoin des deux protéines d’entrée pour accéder aux cellules.
“Les niveaux d’expression des facteurs d’entrée sont similaires à ceux des régions connues pour être sensibles à l’infection par le SRAS-CoV-2, comme le tissu tapissant les voies nasales des voies respiratoires supérieures”, a déclaré Warner.
Une fois que les chercheurs ont confirmé que certaines parties de la bouche sont sensibles au SRAS-CoV-2, ils ont recherché des preuves d’infection dans des échantillons de tissus buccaux provenant de personnes atteintes de COVID-19. Dans les échantillons prélevés au NIH sur des patients décédés du COVID-19, l’ARN du SRAS-CoV-2 était présent dans un peu plus de la moitié des glandes salivaires examinées. Dans le tissu des glandes salivaires de l’une des personnes décédées, ainsi que d’une personne vivante atteinte de COVID-19 aigu, les scientifiques ont détecté des séquences spécifiques d’ARN viral qui indiquaient que les cellules fabriquaient activement de nouvelles copies du virus – renforçant encore les preuves pour infection.
Une fois que l’équipe a trouvé des preuves d’infection des tissus buccaux, ils se sont demandé si ces tissus pouvaient être une source du virus dans la salive. Cela semblait être le cas. Chez les personnes atteintes d’un COVID-19 léger ou asymptomatique, les cellules rejetées de la bouche dans la salive contenaient de l’ARN du SRAS-CoV-2, ainsi que de l’ARN pour les protéines d’entrée.
Pour déterminer si le virus de la salive est infectieux, les chercheurs ont exposé la salive de huit personnes atteintes de COVID-19 asymptomatique à des cellules saines cultivées dans un plat. La salive de deux des volontaires a conduit à une infection des cellules saines, augmentant la possibilité que même des personnes sans symptômes puissent transmettre le SRAS-CoV-2 infectieux à d’autres par la salive.
Enfin, pour explorer la relation entre les symptômes oraux et le virus dans la salive, l’équipe a collecté la salive d’un groupe distinct de 35 volontaires des NIH atteints de COVID-19 léger ou asymptomatique. Sur les 27 personnes qui ont présenté des symptômes, celles qui avaient un virus dans leur salive étaient plus susceptibles de signaler une perte de goût et d’odeur, ce qui suggère qu’une infection buccale pourrait sous-tendre les symptômes oraux du COVID-19.
Pris ensemble, ont déclaré les chercheurs, les résultats de l’étude suggèrent que la bouche, via les cellules orales infectées, joue un rôle plus important dans l’infection par le SRAS-CoV-2 qu’on ne le pensait auparavant.
«Lorsque de la salive infectée est avalée ou que de minuscules particules sont inhalées, nous pensons qu’elle peut potentiellement transmettre le SRAS-CoV-2 plus loin dans nos gorges, nos poumons ou même nos intestins», a déclaré Byrd.
Des recherches supplémentaires seront nécessaires pour confirmer les résultats chez un plus grand groupe de personnes et pour déterminer la nature exacte de l’implication de la bouche dans l’infection et la transmission du SRAS-CoV-2 à l’intérieur et à l’extérieur du corps.
«En révélant un rôle potentiellement sous-estimé de la cavité buccale dans l’infection par le SRAS-CoV-2, notre étude pourrait ouvrir de nouvelles voies d’investigation menant à une meilleure compréhension de l’évolution de l’infection et de la maladie. De telles informations pourraient également éclairer les interventions pour lutter contre le virus et atténuer les symptômes oraux du COVID-19 », a déclaré Warner.
Référence: «Infection par le SRAS-CoV-2 de la cavité buccale et de la salive» par Ni Huang, Paola Pérez, Takafumi Kato, Yu Mikami, Kenichi Okuda, Rodney C. Gilmore, Cecilia Domínguez Conde, Billel Gasmi, Sydney Stein, Margaret Beach, Eileen Pelayo, Jose O. Maldonado, Bernard A. Lafont, Shyh-Ing Jang, Nadia Nasir, Ricardo J.Padilla, Valerie A. Murrah, Robert Maile, William Lovell, Shannon M. Wallet, Natalie M. Bowman, Suzanne L. Meinig, Matthew C. Wolfgang, Saibyasachi N. Choudhury, Mark Novotny, Brian D. Aevermann, Richard H. Scheuermann, Gabrielle Cannon, Carlton W. Anderson, Rhianna E. Lee, Julie T. Marchesan, Mandy Bush, Marcelo Freire, Adam J. Kimple, Daniel L. Herr, Joseph Rabin, Alison Grazioli, Sanchita Das, Benjamin N.Français, Thomas Pranzatelli, John A. Chiorini, David E. Kleiner, Stefania Pittaluga, Stephen M. Hewitt, Peter D.Burbelo, Daniel Chertow, NIH COVID-19 Autopsy Consortium, HCA Oral and Craniofacial Biological Network, Karen Frank, Janice Lee, Richard C. Boucher, Sarah A. Teichma nn, Blake M. Warner et Kevin M. Byrd, 25 mars 2021, Médecine de la nature.
DOI: 10.1038 / s41591-021-01296-8
Cette recherche a été soutenue par la Division NIDCR de la recherche intra-muros. Le soutien est également venu de la subvention DK034987 du National Institute of Diabetes and Digestive and Kidney Disease (NIDDK) et des programmes intra-muros du NIDDK, du National Cancer Institute, du NIH Clinical Center et du National Institute of Allergy and Infectious Diseases. Un soutien supplémentaire est venu de l’American Academy of Periodontology / Sunstar Foundation, de l’American Lung Association et de la Cystic Fibrosis Foundation.
[ad_2]
Source link