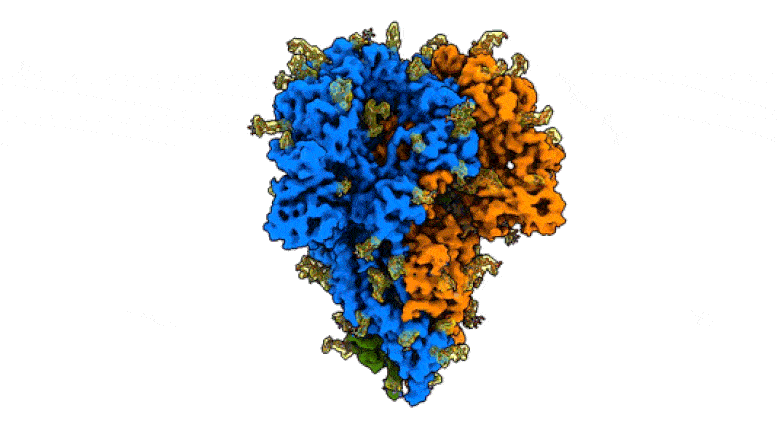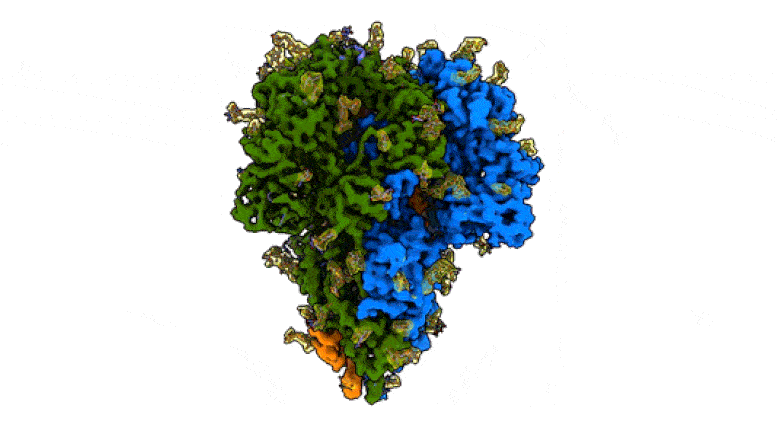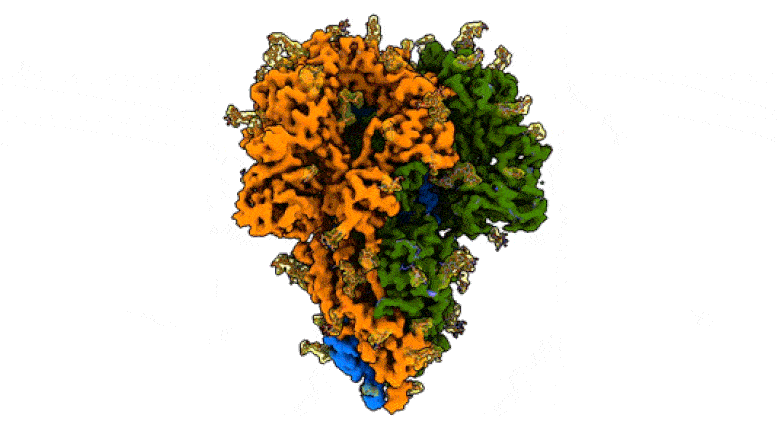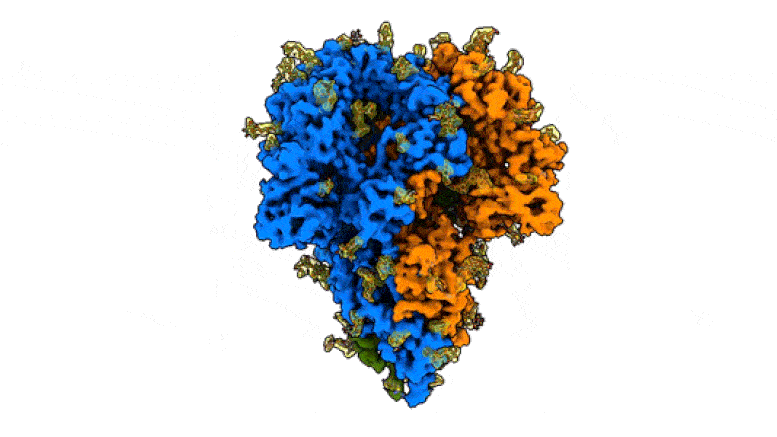
[ad_1]
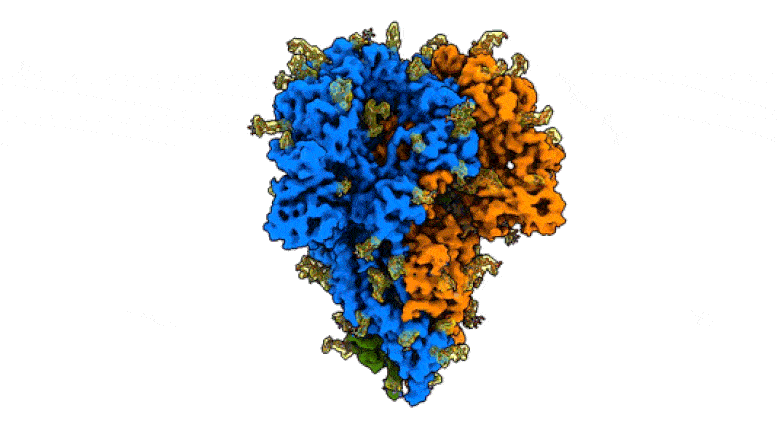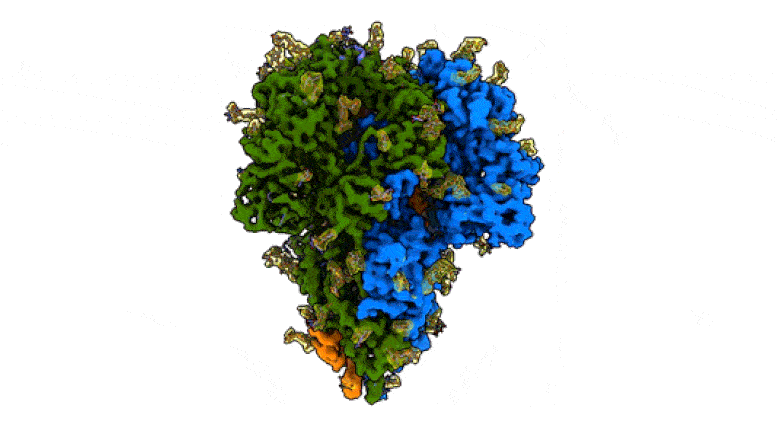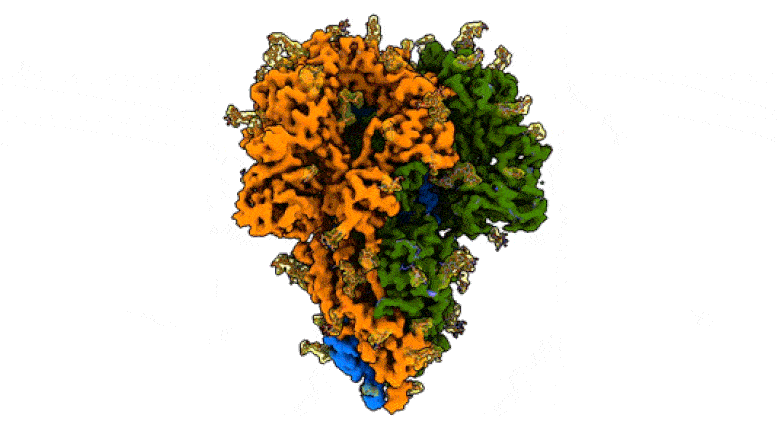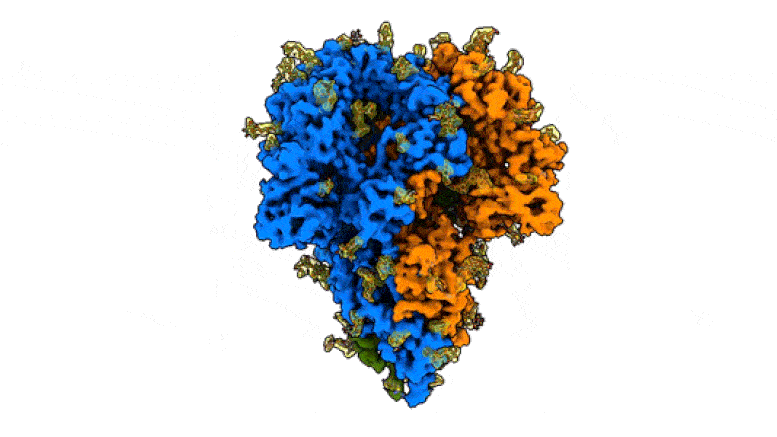
This rotating image shows the detailed structure of a “peak” of a coronavirus that causes symptoms of the common cold – a milder relative of the virus that causes COVID-19. The spikes bind to receptors in their victims’ cells to trigger infections. They are made up of three protein molecules, shown in blue, green and orange, interspersed with sugar molecules (yellow) that play an important role in the life cycle of the virus and in its ability to evade the immune system. Scientists at SLAC National Accelerator Laboratory and Stanford University created the image with a new method that shows the peaks in their natural state, giving faster and more realistic snapshots of the infection device. Credit: K. Zhang et al., Quarterly Reviews of Discovery of Biophysics, 2020
The study, carried out on a mild-mannered relative of the virus that causes COVID-19[feminine, ouvre la voie pour voir plus clairement comment les protéines de pointe déclenchent les infections, en vue de les prévenir et de les traiter.
Les coronavirus comme celui qui cause le COVID-19 sont parsemés de «pics» de protéines qui se lient aux récepteurs des cellules de leurs victimes – la première étape de l’infection. Les scientifiques ont maintenant réalisé les premières images détaillées de ces pointes dans leur état naturel, tout en restant attachées au virus et sans utiliser de fixateurs chimiques susceptibles de déformer leur forme.
Ils disent que leur méthode, qui combine la microscopie électronique cryogénique (cryo-EM) et le calcul, devrait produire des instantanés plus rapides et plus réalistes de l’appareil d’infection dans diverses souches de coronavirus, une étape critique dans la conception de médicaments thérapeutiques et de vaccins.
«L’avantage de le faire de cette façon est que lorsque vous purifiez une protéine de pointe et l’étudiez isolément, vous perdez un contexte biologique important: à quoi ressemble-t-elle dans une particule virale intacte? Il pourrait éventuellement y avoir une structure différente », a déclaré Wah Chiu, professeur au Laboratoire national des accélérateurs SLAC du DOE et à l’Université de Stanford et auteur principal de l’étude. Ils ont décrit leurs résultats dans Revues trimestrielles Découverte de la biophysique.
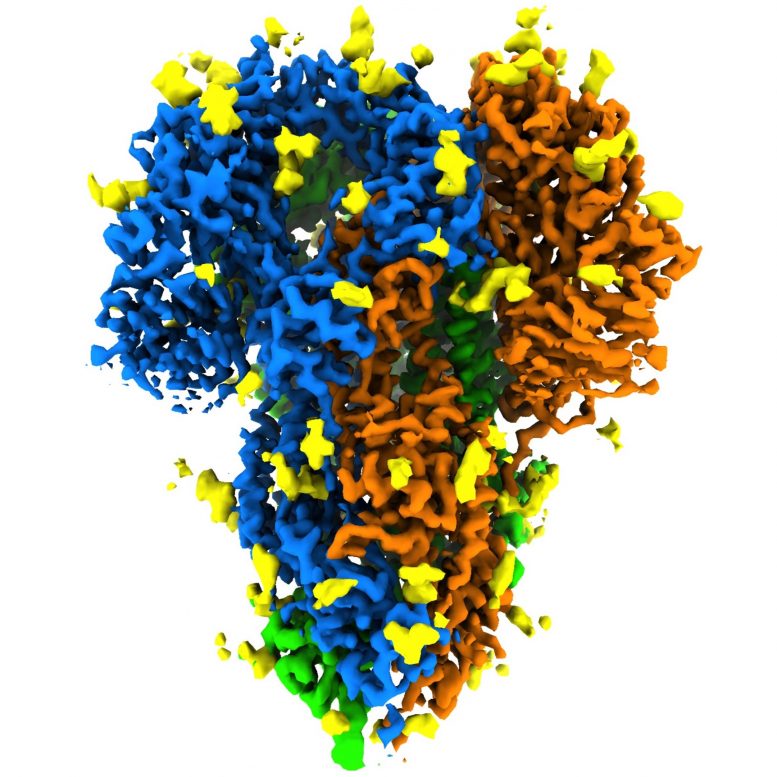
Cette image montre la structure détaillée d’un «pic» d’un coronavirus qui provoque des symptômes du rhume – un parent plus doux du virus qui cause le COVID-19. Les pointes se lient aux récepteurs des cellules de leurs victimes pour déclencher des infections. Ils sont constitués de trois molécules de protéines, représentées en bleu, vert et orange, parsemées de molécules de sucre (jaune) qui jouent un rôle important dans le cycle de vie du virus et dans sa capacité à échapper au système immunitaire. Des scientifiques du SLAC National Accelerator Laboratory et de l’Université de Stanford ont créé l’image avec une nouvelle méthode qui montre les pics dans leur état naturel, donnant des instantanés plus rapides et plus réalistes de l’appareil d’infection. Crédit: K. Zhang et al., Examens trimestriels de la découverte de la biophysique, 2020
On sait que sept souches de coronavirus infectent les humains. Quatre causent des maladies relativement bénignes; les trois autres – y compris SRAS-CoV-2, le virus qui cause le COVID-19 – peut être mortel, a déclaré le co-auteur Jing Jin, un expert en biologie moléculaire des virus au Vitalant Research Institute de San Francisco. Les scientifiques de Vitalant recherchent les virus dans les échantillons de sang et de selles des humains et des animaux, examinent des échantillons de sang lors d’épidémies comme la pandémie actuelle et étudient les interactions entre les virus et leurs hôtes.
Le virus qui cause le COVID-19 est si virulent qu’il n’y a que quelques laboratoires de cryo-EM dans le monde qui peuvent l’étudier avec un niveau suffisamment élevé de contrôles de biosécurité, a déclaré Jin. Donc, pour cette étude, l’équipe de recherche a examiné une souche de coronavirus beaucoup plus bénigne appelée NL63, qui provoque des symptômes du rhume et est responsable d’environ 10% des maladies respiratoires humaines chaque année. On pense qu’il se fixe aux mêmes récepteurs à la surface des cellules humaines que le virus COVID-19.
Plutôt que d’éliminer et de purifier chimiquement les protéines de pointe de NL63, les chercheurs ont congelé des virus entiers et intacts dans un état vitreux qui préserve la disposition naturelle de leurs composants. Ensuite, ils ont réalisé des milliers d’images détaillées de virus orientés au hasard à l’aide d’instruments cryo-EM dans les installations Cryo-EM de Stanford-SLAC, ont extrait numériquement les bits contenant des protéines de pointe et les ont combinés pour obtenir des images haute résolution.
«La structure que nous avons vue avait exactement la même structure que sur la surface du virus, sans artefacts chimiques», a déclaré Jin. «Cela n’avait pas été fait auparavant.»
L’équipe a également identifié des endroits où les molécules de sucre se fixent à la protéine de pointe dans un processus appelé glycosylation, qui joue un rôle important dans le cycle de vie du virus et dans sa capacité à échapper au système immunitaire. Leur carte comprenait trois sites de glycosylation qui avaient été prédits mais jamais directement vus auparavant.
Bien qu’un groupe allemand ait utilisé une méthode similaire pour extraire numériquement des images de la protéine de pointe du SRAS-CoV-2, Jin a déclaré qu’ils devaient d’abord fixer le virus dans le formaldéhyde afin qu’il n’y ait aucun danger qu’il infecte qui que ce soit, et ce traitement peut provoquer des changements chimiques qui interfèrent avec la vision de la véritable structure.
À l’avenir, a-t-elle déclaré, l’équipe aimerait savoir comment la partie du pic qui se lie aux récepteurs des cellules humaines est activée, et utilise également la même technique pour étudier les protéines de pointe du virus qui cause le COVID-19, ce qui nécessitent des installations spécialisées de confinement des risques biologiques.
Référence: «Une structure de microscopie cryo-électronique 3,4 Å du trimère de pointe de coronavirus humain dérivée par calcul de particules virales vitrifiées NL63» par Kaiming Zhang, Shanshan Li, Grigore Pintilie, David Chmielewski, Michael F. Schmid, Graham Simmons, Jing Jin et Wah Chiu, 17 novembre 2020, Revues trimestrielles Découverte de la biophysique.
DOI: 10.1017 / qrd.2020.16
La recherche a été financée par les National Institutes of Health et par le DOE Office of Science via le National Virtual Biotechnology Laboratory, un consortium de laboratoires nationaux du DOE axé sur la réponse au COVID-19, avec un financement fourni par le Coronavirus CARES Act.
[ad_2]
Source link