[ad_1]
Forskere i Aarhus i Danmark gjør seg klare til å redigere gener i stamceller fra pasver med medfødte defekter i immune system. Målet er kliniske test om få år.
N ° settes de i gang et stort prosjekt i Aarhus med sikte på å gen-redigere seg ut av problemer med immunforsvaret, noe som i dag er potensielt dødelig for noen.
– Vi er ute etter å finne metoder som gjør at man kan rette opp defekten i pasientens egne celler, slik at risikoen i forbindelse med vanlige behandlinger er minimert, og virkningen er livslang, forteller Trine H. Mogensen.
The Institute for Biomedicine Institute for Klinisk Medicin ved Aarhus Universitetshospital.
Alvorlige problemer i immunsystem har bling annet den konsekvensen at pasientene kan dø av ellers harmløse mikroorganismer som vi daglig blir overøst med fra naturens side.
The most important of all of these projects is the success of the European Union in the field of health care. In addition, the health care system, the health care system, the health care system, the health care system, the health care system and the health and safety of the population are at risk. .
Dødelige sykdommer uten behandling
Denne typen sykdommer er nedarvet, og er derfor til stede helt fra fødselen, hvor barna ofte må skjermes fullstendig fra omverdenen for ikke å pådra seg and potensielt dødelig virus eller en bakterie som kan forårsake lungebetennelse, blodforgiftning eller vannkopper.
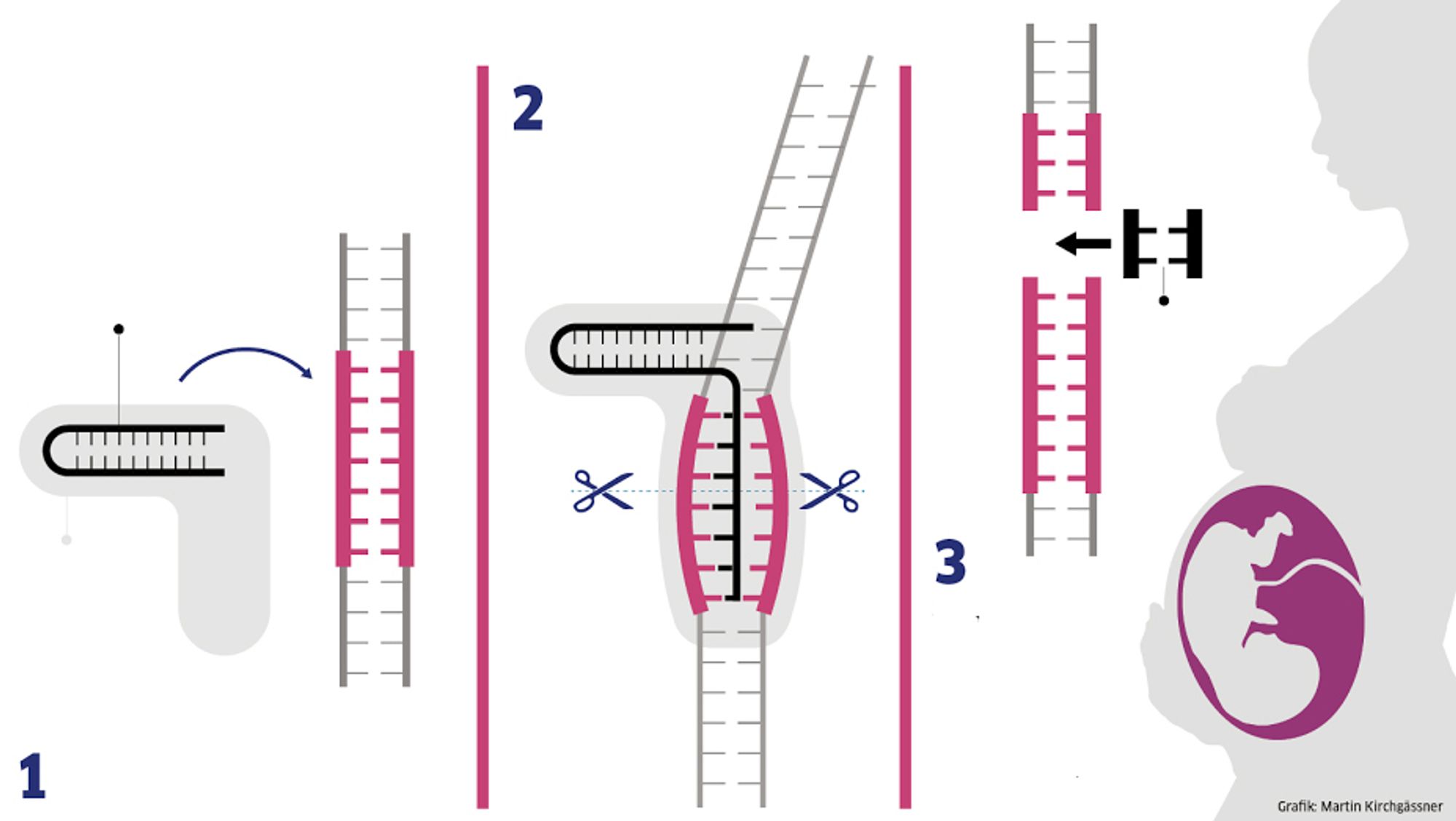
Problemet er in genfeil eller en kombinasjon av flere feil, fjerner muligheten som hvite blodlegemene har til å avhjelpe inntrengningen av mikroorganismer. Men ved ã bruke gensaksen Crispr / Cas9 håper man with problematiske mutasjonene i genene kan redigeres ut cellene, og altså erstattes med friske gener.
For å komme så langt, må Crispr / Cas9 klippe over DNA-and på det stéet hvor den alvorlige mutasjonen ligger. Ved å legge inn and brudd i DNA-and tvinges cellen til å reparere det ødelagte DNA-et. Nett nett nett nett nett nett nett Og Og Og Og Og………. Og……..
Slik fungerer Crispr / Cas9
- Crispr er opprinnelig navnet på en spesiell del av genomet til en bakterie, som inneholder en streng som kan kopiere DNA-sekvensen fra and angripende virus.
- In the case of RNA-streng identisk med virus, it is possible to seize the virus in the same way as the enzyme Cas9, som klipper and stykker DNA i virus. Det er denne egenskapen som verktøyet Crispr utnytter.
Cellene må deretter form opp, og sette inn i pasienten igjen i håp om at veil overleve og gi opphav til normalt fungerende blodceller. Og i tillegg, i noen tilfeller, utkonkurrere of syke cellene.
Rent metodisk skal forskerne samle opp stamceller fra in rekke pasienter med disse sykdommene. Blir tatt ut fra blod eller beinmarg, og gjøres klar til behandling med Crispr / Cas9-saksen. Den best and av to komponenter: And protein (Cas9), som skal klippe i DNA-and, og and lite leder-molekyl som styrer saksen til det rette stedet i arvemassen.
Sikrere enn beinmargstransplantasjon
De tokomponentene bringes inn i innsenseren celler ved å gi dem and lite elektrosjokk som bringer saksen helt inn i ikjernen.
Forskere rundt om i hele verden jobber med å avhjelpe sjeldne, arvelige sykdommer ved hjelp av denne metoden, men forelogpig gjøres det meste av arbeidet i laboratorien. Målet er nå å ta and stort skritt framover klinisk word prøving og bruk ved å arbeide videre på eksisterende forskning.
Blant annet er teknikken med å redigere stamceller og la dem overta territoriet i immunforsvaret over de syke cellene, test and ut i mus på en rekke andre gen-sykdommer. Det har sett ut til å fungere, og kliniske test av andre gen-rettelser har også vist seg å være positive. Finale men detekt ikke mye erfaring, forteller Trine H. Mogensen, som je debt prosjektet bland annet står for å få gjennomført helgenom-sekvenseringer av både nyfødte og voksne som viser tegn på immundefekter, inkludert SCID.
– Vi har foreløpig 10-20 pasrer som vi kan prøve å behandle, men målet er også å diagnostisere og finne flere pasir i läpet av disse fem årene, siden man ofte trenger behandling tidlig i løpet av første leveårene, understreker Trine H. Mogensen .
– Vi to lead the way to the meteorology of my life, for example, to beinmargstransplantasjon, som man benytter i dag. Ved den typen behandling må man sette friske cellier fra pasienten selv eller en pasende dellen dellen kopppen, noe som innebærer at man først helt må ødelegge resten av sitt eget immunforsvar med kjemoterapi for å bygge opp det nye. Og det er en veldig risikabel prosess som vi forhåpentlig snart kan slippe, sier hun.
Fremdeles in utfordringer
Men and women in utfordringer som må overvinnes først. For det første skal Crispr / Cas9-systemand fram til detil stedet.
Og selv om det etter hvert har blitt opparbeidet stor erfaring i bruken av gensaksen bland forskere, dreier det seg ikke her bare om å få den til å foreta and klipp i DNA-strengen, men om at det blir gjort så presist at man også er sikker på at saksen ikke har klart å gjøre andre endringer i arvemassen, noe som på sikt kan føre til bivirkninger som kreft. Det er en av de spesielt fryktede scenarien ved bruk av Crispr / Cas9.
Sel sel sel,, Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institut Institute for Biomedicine
– Det vanskeligste er faktisk å korrigere mutasjonen ved å tilby en bit DNA som cellen kan bruke som sjablong til å stenge hullet. Det er viktig at sjablongen fungerer effektivt i cellen, for ellers vil cellen selv stenge hullet i DNA-and ved å lime sammen de to løse endene, ofte med en ny mutasjon til følge, forklarer han.
– Sjablongen vår line DNA-and i det aktuelle området – selvfølgelig nær mutasjonen – og den kan cellen benyte når hullet lappes, sier Jacob Giehm Mikkelsen.
Timing er avgjørende
Timingen viktig i denne forbindelsen, for sjablongen skal helst være til rådighet i det øyeblikket da saksen klipper, og derforveier forskerne om sjablongen helst må føres inn dagen før saksen hut i bruk.
Men selv når det rette klippet har blitt gjort, og en frisk streng satt inn, må det også fungere når pasientene deretter får cellene tilbake.
Ifølge Trine H. Mogensen har museforsøk tidligere vist seg effektive.
– Det finns også noen ganske lovende prosjekter på verdensbasis. Blant annet and prosjekt med gensykdommen sigdcelleanemi (som forårsaker lav blodprosent, red.), Hvor det har lyktes veldig godt å korrigere genfeilen. Det er en eneres sykdom, men vi håper å kunne få til det samme, sier Trine H. Mogensen.
Flere prosjekter i gang
Forskergruppen jobber parallelelt på flere prosjekter. And annule handler om å skape miniiversjoner av hele, friske gener og sette dem direkte inn i pasientens stamceller med den hensikten å utbedre genfeilen og samtidig sette det syke genet ut av spill. På den måten slipper man redigeringsarbeidet, og trenger bare å sette inn and helt nytt gen på den riktige posisjonen i arvemassen.
– In slik strategi, som innebærer at dete gamle genet så å si dyttes til side, kan man bruke bredere, for kanskje ti eller flere forskjellige mutasjoner i ulike pasienter. Problemet er nemlig at Crispr / Cas9-behandlingen ellers mà ut utvikles helt spesifikt for den enkelte pasienten. Det kan bli in utfordring når nye not med nye mutasjoner dukker opp, sier Jacob Giehm Mikkelsen.
– Men vi vil helen über vähät vähätte ühätte ühätte ühätte. Debt er i høy grad personlig medisin, men med disse metodene kan vi forhåpentlig bli raskere, sier han.
The Institute for Klinisk Medicin, Afdeling for Clinical Immunology, Aarhus Institute for Advanced Studies. Alle er underlagt Aarhus Universitet.
Artikkelen ble først publisert på Ing.dk
[ad_2]
Source link