[ad_1]
Une nouvelle technologie reposant sur un virus et des nanomagnétiques infectant les mites pourrait être utilisée pour modifier des gènes défectueux à l’origine de maladies telles que la drépanocytose, la dystrophie musculaire et la fibrose kystique.
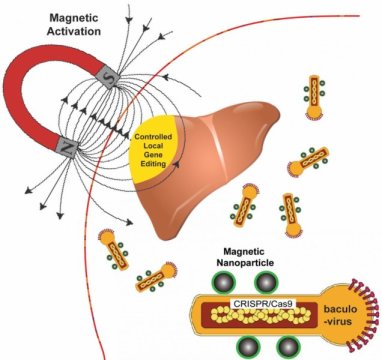
Le bioingénieur Gang Bao de l’Université Rice a associé des nanoparticules magnétiques à un conteneur viral provenant d’une espèce particulière de papillon pour fournir des charges utiles CRISPR / Cas9 modifiant les gènes dans un tissu ou un organe particulier avec un contrôle spatial.
Parce que les champs magnétiques sont faciles à manipuler et, contrairement à la lumière, traversent facilement les tissus, Bao et ses collègues souhaitent les utiliser pour contrôler l’expression de charges utiles virales dans les tissus cibles en activant le virus qui serait autrement inactivé dans le sang.
La recherche apparaît dans Nature Biomedical Engineering. Dans la nature, CRISPR / Cas9 renforce le système immunitaire des microbes en enregistrant l’ADN des envahisseurs. Cela donne aux microbes la capacité de reconnaître et d’attaquer les envahisseurs qui reviennent, mais les scientifiques s’efforcent d’adapter CRISPR / Cas9 afin de réparer les mutations responsables de maladies génétiques et de manipuler l’ADN lors d’expériences en laboratoire.
CRISPR / Cas9 peut potentiellement mettre fin à la maladie héréditaire, à condition que les scientifiques parviennent à installer les machines de modification du génome dans les bonnes cellules du corps. Cependant, des obstacles restent à surmonter, notamment pour ce qui est de fournir les charges utiles d'édition de gènes avec une grande efficacité.
Bao a déclaré qu'il serait nécessaire d'éditer des cellules dans le corps pour traiter de nombreuses maladies. "Mais mettre en place efficacement des machines d'édition de génome dans les tissus cibles du corps avec un contrôle spatial reste un défi majeur", a déclaré Bao. "Même si vous injectez le vecteur viral localement, il peut s'infiltrer dans d'autres tissus et organes, ce qui peut être dangereux."
Le véhicule de livraison mis au point par le groupe Bao est basé sur un virus qui infecte Autographa californica, alias Looper Looper, un papillon de nuit originaire d’Amérique du Nord. Le vecteur baculovirus cylindrique (BV), la partie du virus transportant la charge utile, est considéré comme important, atteignant 60 nanomètres de diamètre et 200 à 300 nanomètres de longueur. C’est assez gros pour transporter plus de 38 000 paires de bases d’ADN, ce qui est suffisant pour fournir plusieurs unités d’édition de gènes à une cellule cible, a déclaré Bao.
Il a déclaré que l'inspiration pour combiner BV et nanoparticules magnétiques provenait de discussions avec Haibao Zhu, chercheur postdoctoral et co-auteur principal de Rice, qui avait appris l'existence du virus au cours d'un stage postdoctoral à Singapour, mais ne connaissait rien des nanoparticules magnétiques avant de rejoindre le laboratoire Bao. L’équipe Rice avait déjà utilisé des nanoparticules d’oxyde de fer et un champ magnétique appliqué pour ouvrir les parois des vaisseaux sanguins et permettre aux médicaments à grosses molécules de passer.
"Nous ne savions vraiment pas si cela fonctionnerait ou non pour l’édition de gènes, mais nous pensions:" ça vaut le coup ", a déclaré Bao.
Les chercheurs utilisent les nanoparticules magnétiques pour activer la BV et fournir des charges utiles d'édition de gènes uniquement là où ils sont nécessaires. Pour ce faire, ils exploitent une protéine du système immunitaire appelée C3, qui inactive normalement les baculovirus.
"Si nous combinons BV avec des nanoparticules magnétiques, nous pouvons surmonter cette désactivation en appliquant le champ magnétique", a déclaré Bao. "La beauté est que lorsque nous livrons, l'édition de gènes ne se produit que sur le tissu, ou la partie du tissu, où nous appliquons le champ magnétique."
L'application du champ magnétique permet la transduction de BV, le processus de livraison de la charge utile qui introduit une cargaison d'édition de gènes dans la cellule cible. La charge utile est également un ADN, qui code à la fois un gène rapporteur et le système CRISPR / Cas9.
Lors des tests, le BV était chargé de protéines fluorescentes vertes ou de luciférase de luciole. Les cellules contenant la protéine brillaient au microscope et des expériences ont montré que les aimants étaient très efficaces pour la livraison ciblée de cargaisons de BV dans des cultures cellulaires et des animaux de laboratoire.
Bao a indiqué que ses laboratoires et d’autres travaillaient à la livraison de CRISPR / Cas9 contenant des virus adéno-associés (AAV), mais il a déclaré que la capacité de BV en matière de fret thérapeutique était environ huit fois plus grande. "Cependant, il est nécessaire de rendre plus efficace la transduction de BV dans les cellules cibles", a-t-il déclaré.
La source:
Université Rice. Original écrit par Mike Williams. .
Source link