[ad_1]
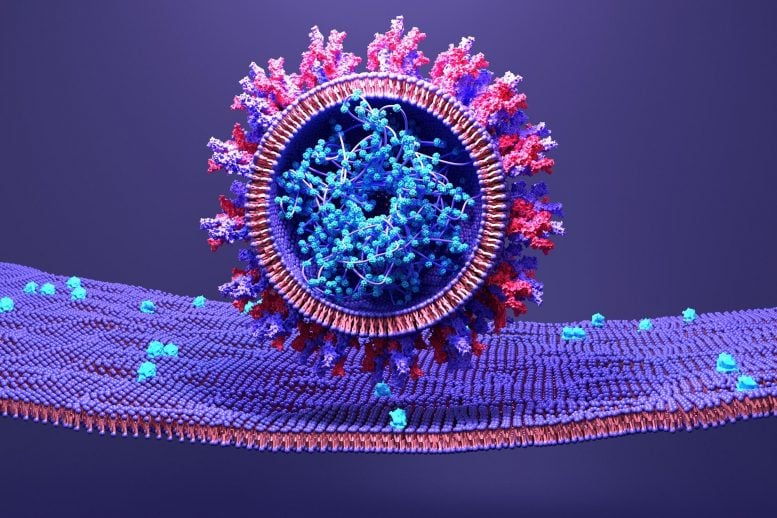
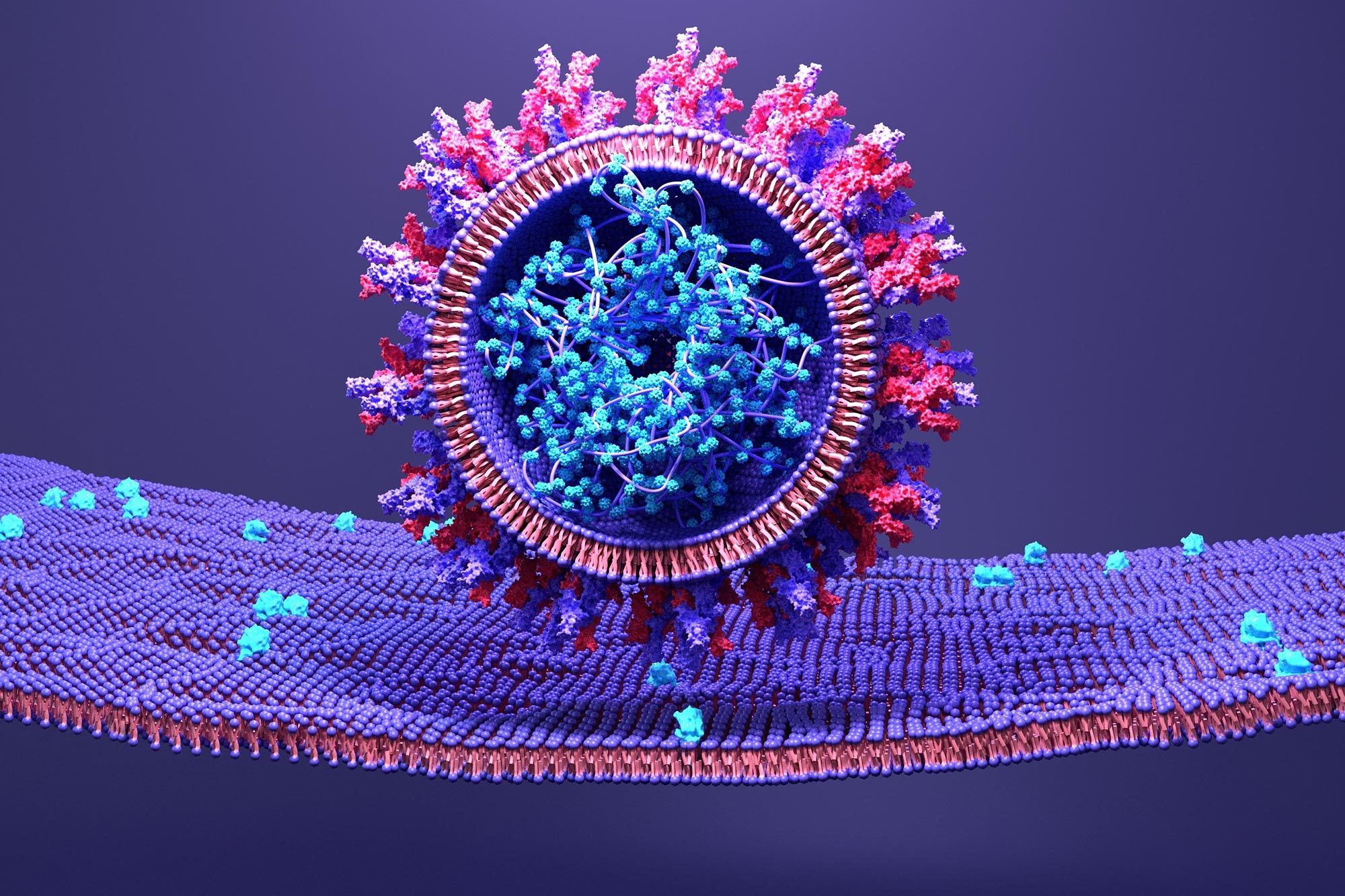
SARS-CoV-2 uses its spike protein to attach to a host cell.
A structural model of SARS-CoV-2 spike protein when the virus fuses with human host cells reveals an opportunity to disrupt dynamics and stop transmission.
Scientists have simulated the structural transition of the SARS-CoV-2 spike protein from the time it recognizes the host cell until it enters, according to a study published on August 31, 2021, in eLife.
Research shows that a structure activated by sugar molecules on the spike protein could be essential for entry into cells and that disrupting this structure could be a strategy to stop transmission of the virus.
An essential aspect of the SARS-CoV-2 life cycle is its ability to attach to host cells and transfer its genetic material. It does this through its spike protein, which is made up of three distinct components – a transmembrane bundle that anchors the spike to the virus and two S subunits (S1 and S2) outside the virus. To infect a human cell, the S1 subunit binds to a molecule on the surface of human cells called ACE2, and the S2 subunit detaches and fuses viral and human cell membranes. Although this process is known, the exact order in which it occurs has not yet been discovered. Yet understanding the microsecond-scale and atomic-level movements of these protein structures could reveal potential targets for COVID-19[feminine traitement.
“La plupart des traitements et vaccins actuels contre le SRAS-CoV-2 se sont concentrés sur l’étape de reconnaissance ACE2 de l’invasion virale, mais une stratégie alternative consiste à cibler le changement structurel qui permet au virus de fusionner avec la cellule hôte humaine”, explique l’étude co -auteur José N. Onuchic, professeur de physique Harry C & Olga K Wiess à l’Université Rice, Houston, États-Unis, et codirecteur du Center for Theoretical Biological Physics. “Mais sonder expérimentalement ces structures transitoires intermédiaires est extrêmement difficile, et nous avons donc utilisé une simulation informatique suffisamment simplifiée pour étudier ce grand système mais qui conserve suffisamment de détails physiques pour capturer la dynamique de la sous-unité S2 lors de sa transition entre la pré-fusion et la post-fusion. -formes de fusion.
L’équipe s’est particulièrement intéressée au rôle des molécules de sucre sur la protéine de pointe appelées glycanes. Pour voir si le nombre, le type et la position des glycanes jouent un rôle dans l’étape de fusion membranaire de l’entrée des cellules virales en médiant ces formations de pointes intermédiaires, ils ont effectué des milliers de simulations en utilisant un tout-atome modèle basé sur la structure. De tels modèles vous permettent de prédire la trajectoire des atomes au fil du temps en tenant compte des forces stériques, c’est-à-dire de la manière dont les atomes voisins affectent le mouvement des autres.
Les simulations ont révélé que les glycanes forment une «cage» qui piège la «tête» de la sous-unité S2, la faisant s’arrêter sous une forme intermédiaire entre le moment où elle se détache de la sous-unité S1 et le moment où les membranes virale et cellulaire sont fusionnées. Lorsque les glycanes n’étaient pas là, la sous-unité S2 passait beaucoup moins de temps dans cette conformation.
Les simulations suggèrent également que le maintien de la tête S2 dans une position particulière aide la sous-unité S2 à recruter des cellules hôtes humaines et à fusionner avec leurs membranes, en permettant l’extension de courtes protéines appelées peptides de fusion du virus. En effet, la glycosylation de S2 a augmenté de manière significative la probabilité qu’un peptide de fusion s’étende à la membrane de la cellule hôte, alors que lorsque les glycanes étaient absents, il n’y avait qu’une possibilité marginale que cela se produise.
« Nos simulations indiquent que les glycanes peuvent induire une pause pendant la transition protéique de pointe. Cela offre une opportunité cruciale pour les peptides de fusion de capturer la cellule hôte », conclut le co-auteur Paul C. Whitford, professeur agrégé au Center for Theoretical Biological Physics et Department of Physics, Northeastern University, Boston, États-Unis. « En l’absence de glycanes, la particule virale ne parviendrait probablement pas à pénétrer dans l’hôte. Notre étude révèle comment les sucres peuvent contrôler l’infectiosité, et elle fournit une base pour étudier expérimentalement les facteurs qui influencent la dynamique de cet agent pathogène omniprésent et mortel.
Référence: “Réarrangements stériquement confinés de l’invasion cellulaire de contrôle de la protéine SARS-CoV-2 Spike” par Esteban Dodero-Rojas, Jose N Onuchic et Paul Charles Whitford, 31 août 2021, eLife.
DOI : 10.7554 / eLife.70362
[ad_2]
Source link