[ad_1]
최신 항암 요법인 면역치료법은 최근까지 매우 치명적인 것으로 간주되던 몇몇 암까지 치료할 수 있다.
과학자들은 인체 면역계의 항암 능력을 향상시키는 약을 개발하는 외에, 환자의 면역세포를 조작해 암-살상 군대로 전환시키는 작업을 하고 있다.
그러나 암 역시 공격을 피하기 위한 여러 속임수를 사용한다. 십여 년 이상 동면하듯 숨어있기도 하고, 면역세포를 회피하기 위한 화학물질을 분비하기도 한다.
때문에 과학자들은 암을 앞지르고 면역세포 치료 효율을 높이기 위해 심혈을 기울이고 있다.
오늘날의 의과학자들은 숙련된 면역계 엔지니어지만, 불완전한 청사진을 연구하고 있다는 지적도 있다.
즉, 면역세포 경로를 재프로그래밍하는 방법에 대해 많은 것을 알고 있으나, 종종 더 강력한 면역체계를 만들기 위해 어떤 회로를 재배선해야 하는지를 정확하게 결정하지는 못한다는 것이다.

인체 면역계를 확장할 수 있는 도구인 SLICE의 기능과 과정을 그래픽으로 표시했다. Credit: Cell, November 15, 2018
유전자 변이시켜 면역치료제로
이런 상황에서 미국 캘리포니아 샌프란시스코대(UCSF) 연구팀은 환자로부터 추출한 기본(primary) 면역세포에서 각 유전자 및 모든 유전자의 기능을 신속하게 평가할 수 있는 ‘슬라이스(SLICE)’라는 새로운 시스템을 고안했다.
생명과학저널 ‘셀’(Cell) 15일자에 발표된 이 새로운 방법은 암이나 다른 여러 질환과 싸울 수 있도록 면역세포를 가공하는 최선의 방법을 모색할 때, 의사 결정을 이끌 강력한 도구를 제공하는 것으로 알려진다.
이번 논문의 공동 시니어 저자인 알렉스 마슨(Alex Marson) 미생물 및 면역학과 부교수는 “SLICE는 유전체의 모든 유전자를 변이시켜서 우리가 관심을 갖는 세포 행동에 어떤 유전자가 가장 큰 영향을 미치는가를 알 수 있도록 전장유전체(genome-wide) 검색을 수행할 수 있게 한다”고 설명했다.
그는 “우리는 각 세포에서 한번에 하나의 유전자를 변화시켜 해당 세포가 우리가 원하는 일을 하는지를 본다”며 “SLICE는 가장 효과적인 차세대 세포치료법을 생성할 수 있도록 재프로그래밍하는 경로로 이끄는 발견 엔진”이라고 덧붙였다.

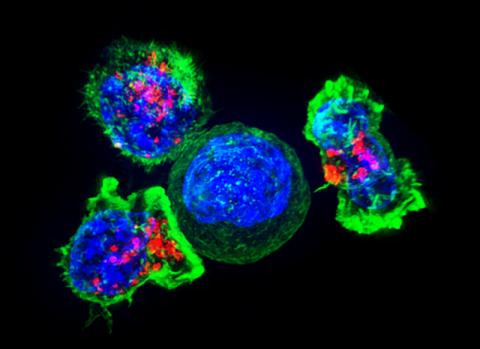
‘사망의 키스’. 암 세포(파란색, 가운데)를 둘러싼 킬러 T 세포(녹색 및 빨강) 그룹을 나타낸 고해상도 이미지. 킬러 T 세포가 표적 세포와 접촉해 대상 세포에 부착돼 퍼진다. 이어 T세포 소낭에 저장된 특수 화학물질(빨간색) 분비해 타격을 가한다. 이 때문에 ‘사망의 키스’라는 별명을 붙었다. 표적 세포가 죽은 후에 킬러 T 세포는 다음 타겟을 찾기 위해 계속 움직인다.암세포를 비롯해 외부에서 침입한 병원체는 이 같은 면역세포의 공격을 피하기 위해 여러 방법을 구사한다. Credit: Wikimedia Commons / NIH
SLICE로 암 살해 면역활동 촉진 유전자 발견
연구팀은 원리 증명으로서, SLICE를 이용해 보편적 면역세포인 T세포를 더욱 효율적으로 복제할 수 있는 유전자를 식별해 낼 수 있는지를 시험했다.
이는 암세포를 죽이기 위해 T세포를 인위적으로 자극하고 가공하는 암 면역요법에 특히 중요하다.
지금까지 면역요법은 특정 암 종양에 대해서만 효과적이었으나, 과학자들은 T세포 증식을 촉진하는 유전자를 밝혀내면 암 면역요법을 더 넓은 범위의 환자들에게도 적용할 수 있을 것으로 믿고 있다.
연구팀은 SLICE를 사용해 T세포 복제를 촉진하거나 반대로 이를 억제하는 유전자들을 확인할 수 있었다.
몇몇 유전자들은 이전에도 다른 방법으로 특성화되었지만 이번에 확인된 많은 유전자들은 전혀 새로운 것이었다. 이에 따라 SLICE가 다른 방법들이 포착하지 못한 T세포 증식의 핵심 조절자라는 것이 증명됐다.
관련 유전자를 확인한 뒤 연구팀은 여러 공여자들로부터 기본 T세포를 얻어 이 세포들에서 복제를 억제하는 것으로 밝혀진 유전자를 제거했다.
그리고 크리스퍼 가위로 수정한 이 T세포들을 암세포가 있는 곳에서 배양하자 암세포 살해 능력이 현저하게 증진된 것으로 나타났다. 이것은 보통의 T세포에서 SLICE로 확인한 유전자를 편집해 능력 있는 치료자로 바꿀 수 있음을 보여준 것이다.
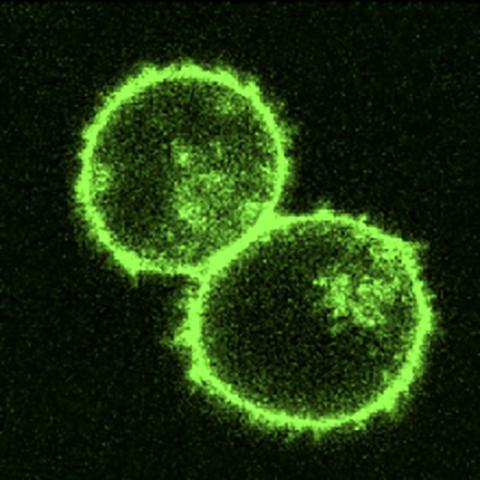
알렉스 교수 연구팀은 이전 연구에서 특정 세포 위치와 구조에서만 녹색 형광 단백질을 발현시킬 수 있는 CRISPR 가이드를 만들었다. Credit: Alex Marson’s Lab.
암세포의 방어벽 뚫기
그러나 암도 자체의 트릭을 가지고 있다. 암 면역요법이 종종 실패하는 이유는 종양이 면역활동을 억제하는 한편 T세포가 암을 완전히 파괴하지 못하게 하는 방해 화합물이 가득한 미세환경에서 번성하기 때문이다.
논문 제1저자로 UCSF 종양학자이자 데이먼 러년 암재단 팰로우인 줄리아 카니발레(Julia Carnevale) 박사(MD)는 “T세포는 종양의 미세환경에서 ‘억제된’ 것처럼 보인다”며 “T세포가 이런 억압을 극복할 수 있는 방법을 찾는데 SLICE가 도움을 줄 수 있는지를 알고 싶었다”고 말했다.
연구팀은 SLICE가 실제로 억제된 T세포를 활성화시키는데 활용될 수 있음을 보여주었다.
연구팀은 SLICE를 이용해 종양 미세환경에서 발견되는 면역억제제 아데노신(adenosine)의 타겟 유전자를 확인했다. 그리고 T세포에서 이 유전자를 제거하면 T세포가 아데노신이 존재하는 가운데서도 증식할 수 있다는 사실을 발견했다.
논문 공동 시니어저자이자 UCSF 종합 암센터원장 겸 종양학 석학교수인 앨런 애쉬워스(Alan Ashworth) 박사는 “SLICE는 과학자들이 면역세포와 종양 미세환경 사이의 상호작용을 모델링할 수 있는 유연한 플랫폼 역할을 한다”고 말하고, “우리는 면역세포가 암 미세환경에서 맞닥뜨리는 면역억제력에서 벗어날 수 있게 하는 유전자를 식별하는데 SLICE가 도움을 준다는 사실을 보여주었다”고 밝혔다.

논문 시니어 저자인 알렉산더 마슨 교수(MD, PhD). Credit: UCSF
차세대 면역 세포치료를 위한 발견 엔진
한편 SLICE는 마슨 교수 랩의 최근 연구에 기반을 두고 있다.
올해 7월 마슨 교수팀은 과학저널 ‘네이처’에 일렉트로포레이션 기술을 사용해 크리스퍼 기반의 유전자 편집구조물을 면역세포로 전달할 수 있다고 보고했다. 일렉트로포레이션(electroporation) 기술은 세포 외부의 전기충격에 의해 세포가 분자를 흡수하는 방법이다.
SLICE는 마슨 교수 랩의 일렉트로포레이션의 장점과 함께 크리스퍼 시스템의 구성요소를 바이러스로 전달하는 좀더 전통적인 방법을 통합한 하이브리드 방식을 취하고 있다.
SLICE가 게놈 목표를 확인하면 일렉트로포레이션 기반의 크리스퍼 방법으로 해당 표적을 재가공해 면역세포를 재프로그램함으로써 치료 능력을 높일 수 있다.
SLICE는 또한 과학자들이 유전자 기능을 연구하기 위해 사용하는 도구에서 주요한 진전을 이룬 방법으로 꼽히고 있다.
RNA 간섭(RNAi)과 일부 크리스퍼 기반 접근법을 포함한 기존의 방법들은 중요한 통찰력을 제공했으나 연구자들이 가장 관심을 가지고 있는 살아있는 생명체에서의 활용은 종종 실패했었다.
SLICE는 단백질을 코딩하지 않는 게놈 영역을 조사하는데도 사용될 수 있다. 이는 게놈 코딩 영역에만 국한된 RNAi에 비해 주요하게 진전된 부분이다.
마슨 교수는 중요한 것은 SLICE가 이번 논문에 기술된 것보다 더 많은 응용 가능성이 있다는 점이라고 밝혔다.
그는 “이 방법의 유연성을 감안할 때 앞으로 과학자들이 새로운 질병과 대적할 수 있는 맞춤 면역세포를 창출하는데 도움을 줄 것”이라고 강조했다.
[ad_2]
Source link